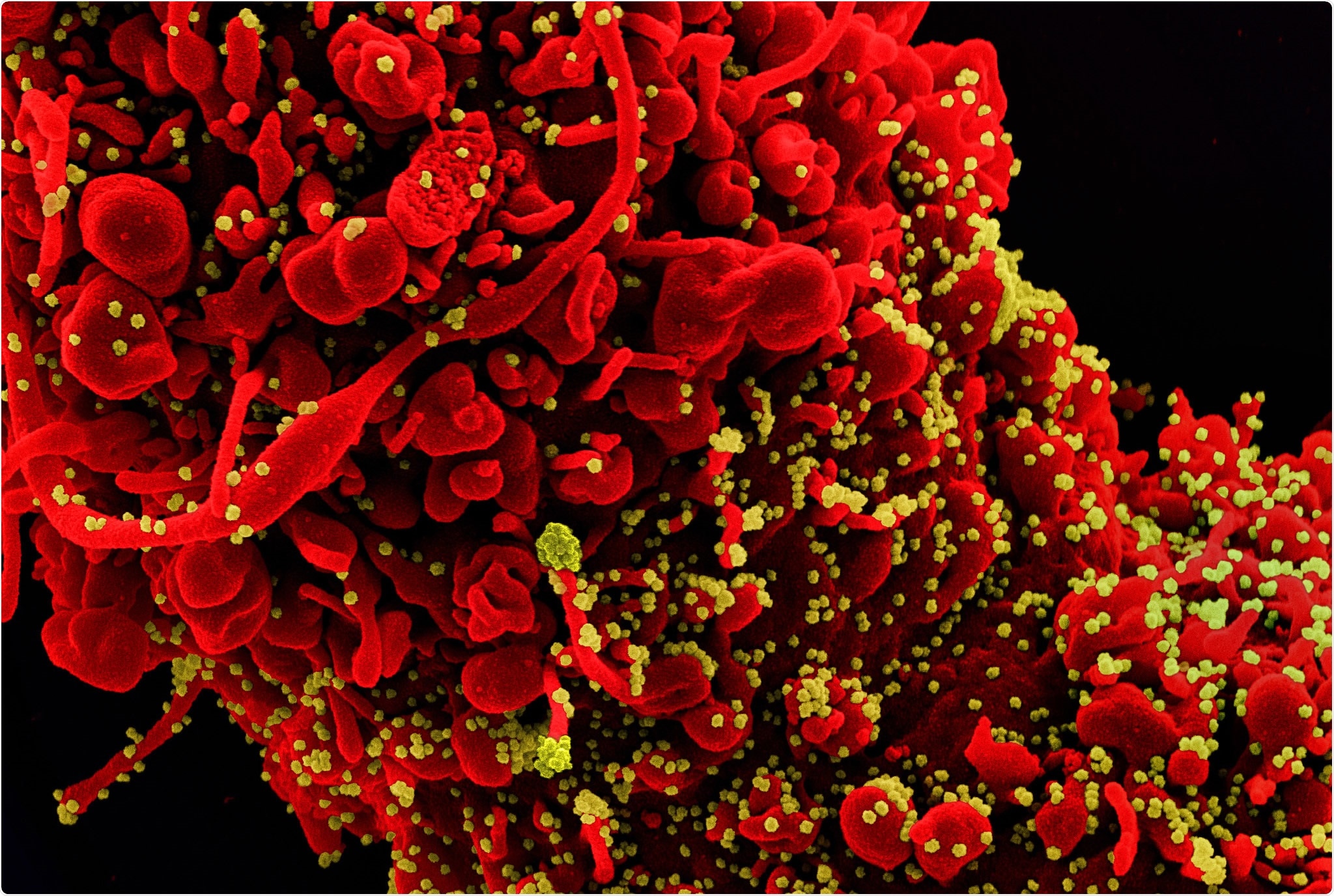
A fines de diciembre de 2019, apareció el Coronavirus 2 (SARS-CoV-2) en Wuhan, China, y posteriormente se extendió rápidamente por todo el mundo. El 11 de marzo de 2020, la Organización Mundial de la Salud declaró pandemia el brote de enfermedad por coronavirus de 2019 (COVID-19). Los científicos de todo el mundo están trabajando a gran escala para desarrollar nuevas vacunas, tratamientos y muchas otras estrategias para contener la epidemia.
El SARS-CoV-2 es un virus de ARN monocatenario de significado positivo que pertenece al género Betacoronavirus de la familia Coronaviridae. Algunos miembros de esta familia afectan a los humanos al causar el resfriado común (HCoV-229E, HCoV-NL63 y HCoV-OC43), SARS (síndrome respiratorio agudo severo) y síndrome respiratorio de Oriente Medio (MERS).
Entre ellos, el SARS-CoV-2 es el más contagioso y causa síntomas de leves a graves. El SARS-CoV-2 codifica proteínas estructurales y no estructurales. Las proteínas estructurales incluyen proteína de espiga (S), proteína de envoltura (E), proteína de membrana (M) y proteína de nucleocápside (N).
Proteína N
Los científicos informan que todas las proteínas estructurales pueden usarse como vacuna candidata. Por ejemplo, la proteína N se une a los complejos de réplicas transcripcionales y participa en la encapsulación, transcripción y replicación del virus. La proteína N estimula anticuerpos potentes, que a su vez pueden conducir a la producción de citocinas.
ORF3a
El marco de lectura abierto 3a (ORF3a) también es esencial para la reproducción viral y la virulencia del virus del SARS. La función de ORF3a es estimular la expresión del gen pro-IL-1β y la secreción de IL-1β que afecta gravemente a los pulmones.
Los investigadores revelaron que había poca información disponible sobre la causa del virus. Por lo tanto, se necesita más investigación, basada en inmunohistoquímica, para determinar los epítopos inmunes.
El estudio actual
Se publicó un nuevo estudio en Revista de estructura y dinámica biomolecular El cual se enfoca en evaluar las proteínas E, M, N, ORF10, ORF8, ORF3a y M utilizando herramientas bioinformáticas para desarrollar una vacuna policíclica para COVID-19. Los investigadores utilizaron métodos silico para inducir respuestas inmunes humorales y celulares.
Estudios genéticos anteriores revelaron que el SARS-CoV y el SARS-CoV-2 son aproximadamente un 80% similares. Además, los investigadores informan que es necesaria una respuesta sólida de las células T a los virus para eliminar las infecciones por virus respiratorios, como el SARS y la influenza A. Además, tanto la inmunidad humoral como la celular juegan un papel crítico en la protección contra estas enfermedades.
Durante esta infección se ha observado el desarrollo de anticuerpos muy activos contra la proteína N del SARS-CoV. Sin embargo, una de las principales limitaciones de este tipo de anticuerpo es que tiene una vida más corta en pacientes recuperados. Combinado con inmunidad humoral, respuestas celulares (p. Ej., CD4+ Y CD8+También proporciona protección contra COVID-19 para personas por más tiempo.
Los investigadores demostraron que una vacuna multivariante podría reconocer y combinar epítopos de células B y T que pueden estimular de manera eficiente el sistema inmunológico y provocar respuestas inmunitarias más efectivas. Los científicos han desarrollado recientemente con éxito vacunas con CD8+ Célula T citolítica (CTL), célula B y CD4+ Epítopos de células T colaboradoras (HTL).
El presente estudio diseñó una nueva proteína de fusión multibyte (proteína N, proteína M y ORF3a) que contiene dominios ricos en antígenos.
La actividad biológica de esta proteína de fusión se evaluó mediante herramientas bioinformáticas. Se evaluó la interacción entre el candidato a vacuna, el receptor del sistema inmune innato (TLR4) y el receptor del sistema inmune celular (HLA-A * 11: 1).
Este estudio utilizó un servidor Rankpep que analizó los supertipos de HLA para predecir diferentes bucles de secuencias de proteínas N, ORF3a y M de acuerdo con los alelos HLA I y HLA II.
Para la predicción del pezón lineal, los investigadores utilizaron el servidor Bepipred, que también predijo los epítopos de las proteínas N, ORF3a y M. Dado que tanto las respuestas celulares como las humorales son obligatorias para una protección eficaz contra la infección por coronavirus, utilizando análisis in-silico, cinco Los dominios ricos en pezones que poseen altos grados de epítopos son comunes entre los epítopos de las células T y las células B.
Se utilizó VaxiJen v2.0 para identificar el antígeno de una proteína manipulada. El análisis de la proteína NOM mostró la presencia de un antígeno fuerte sin adyuvantes. Además, los investigadores predijeron la posibilidad de una reacción alérgica a la proteína diseñada usando iAllertop e informaron una falta de sensibilidad a esta proteína.
Los investigadores también analizaron los parámetros fisicoquímicos (peso molecular, residuos con carga positiva y negativa, puntos isoeléctricos, etc.) y concluyeron que la proteína modificada podría ser un candidato adecuado para una vacuna. Anclaron NOM con TLR4 (receptor tipo Toll) y el receptor HLA-A * 11: 1, y la interacción provocó una respuesta inmune. La simulación de dinámica molecular (MD) aseguró la estabilidad de las estructuras proteicas.
En el estudio actual, los investigadores utilizaron los servidores web PatchDock y Firedock para determinar la interacción óptima entre la proteína NOM y los receptores inmunes. Utilizaron el poder mundial como punto de referencia para seleccionar los mejores complejos. En el análisis de oscilación de raíz cuadrada (RMSF), los valores de la proteína recombinante NOM en la simulación de MD sugirieron una fluctuación de la forma del monómero de la vacuna en varias regiones.
Esto indica que la proteína recombinante NOM fue más estable cuando se complementó con el receptor inmune. Además, en un estudio comparativo, los valores de RMSF para la proteína recombinante NOM en el compuesto con HLA-A * 11: 1 fueron más bajos que los de la proteína recombinante NOM en el compuesto con TLR4.
Debido a que las energías de unión también son más bajas, los investigadores concluyeron que la proteína recombinante NOM podría unirse a HLA-A * 11: 1 mejor que el otro inmunorreceptor. Este resultado también fue validado por un análisis estructural.

«Alborotador. Amante de la cerveza. Total aficionado al alcohol. Sutilmente encantador adicto a los zombis. Ninja de twitter de toda la vida».





More Stories
Estudio: la actividad de las proteínas cancerosas aumenta el desarrollo del cáncer de próstata
Un nuevo material luminoso puede ser la solución al deterioro de las infraestructuras
Las vesículas extracelulares son prometedoras en el tratamiento de lesiones pulmonares y cerebrales durante el nacimiento